Lo dicono le evidenze cliniche:
I Monociti Curano.
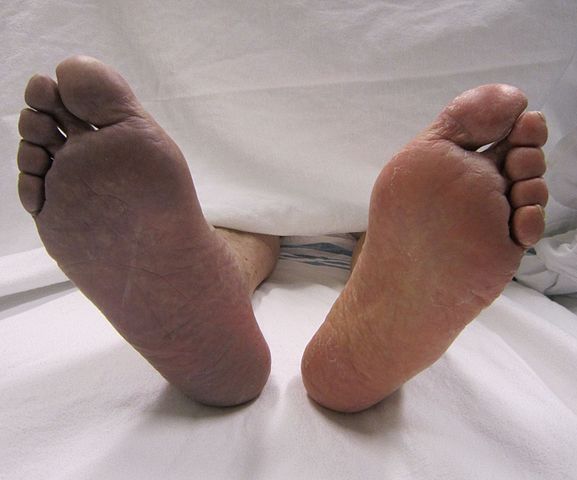
Arteriopatia Obliterante - Un grave problema
Ad oggi non esiste terapia farmacologica efficace per l'arteriopatia obliterante. [6] La terapia primaria consiste nella rivascolarizzazione della parte interessata tramite varie procedure chirurgiche, ma purtroppo le statistiche dicono che molti pazienti - fino al 50% - non possono essere sottoposti a tali interventi per problemi anatomici o di elevato rischio chirurgico legato alle precarie condizioni di salute. [1]. Le statistiche sono spietate: tra i non rivascolarizzati, da un terzo a metà vanno incontro all'amputazione entro un anno, ed un quinto muore entro sei mesi. [4] [5]
Il ruolo dei monociti
Si è infatti appurato che, quando lo stato ischemico innesca nell'endotelio vascolare il complesso meccanismo della neovascolarizzazione, gli attori principali sono i leucociti [9] ed in particolar modo le cellule mononucleate presenti nel sangue periferico (chiamate PB-MNC, dall'inglese Peripheral Blood Mono - Nucleated Cells), che intervengono nella lesione producendo importanti quantità di citochine per stimolare la crescita vascolare tramite vari meccanismi paracrini. Tra i meccanismi stimolati vi sono la rimodellazione della matrice extracellulare, il reclutamento di cellule endoteliali progenitrici, il supporto alla crescita di nuovo endotelio e, ultimo ma decisamente più importante di tutti, lo stimolo dell'arteriogenesi de novo. [10], [11], [12], [13], [14], e [15] .Ulteriori studi hanno confermato che il ruolo dei monociti in questo contesto è talmente importante che la loro assenza induce un drastico calo della neovascolarizzazione [10] e vi è un rapporto diretto tra il loro accumulo e la densità capillare dinal nella lesione [16],
Efficacia comprovata da trial clinici
Gli studi inizialmente si erano concentrati sull'uso di monociti da midollo osseo (BM-MNC), ma si è poi scoperto che i monociti da sangue periferico (PB-MNC) non solo sono molto più facilmente accessibili di quelli da midollo ma sono funzionalmente equivalenti alle loro controparti da midollo. [27]. Non solo, ma i pazienti che avevano ricevuto terapia con monociti periferici aveva una frazione monocitaria maggiore di quelli trattati con monociti da midollo.[28],
Bibliografia
- Norgren L, Hiatt WR, et al.: Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II). Eur J Vasc Endovasc Surg 2007;33(Suppl 1):S1-75.
- ovo S, Coppola G, Milio G.: Critical limb ischemia: definition and natural history. Current Drug Targets Cardiovasc Haematol Disord 2004;4:219-25.
- Blecha MJ. Critical limb ischemia. Surg Clin of North Am 2013;93:789-812. viii.
- Bertele V, Roncaglioni MC et al: Clinical outcome and its predictors in 1560 patients with critical leg ischaemia. Chronic Critical Leg Ischaemia Group. Eur J Vasc Endovasc Surg 1999;18:401-10.
- Dormandy J, Heeck L, Vig S.The fate of patients with critical leg ischemia. Semin Vasc Surg 1999;12:142-7.
- Biancari F. Meta-analysis of the prevalence, incidence and natural history of critical limb ischemia. J Cardiovas Surg 2013;54:663-9.
- Folkman J, Shing Y. Angiogenesis. J Biol Chem 1992;267: 10931-4.
- Hockel M, Schlenger K, Doctrow S, Kissel T, Vaupel P. Therapeutic angiogenesis. Arch Surg 1993;128:423-9.
- Lawall H, Bramlage P, Amann B. Treatment of peripheral arterial disease using stem and progenitor cell therapy. J Vasc Surg 2011;53:445-53.
- Arras M,Ito WD,et al.: Monocyte activation in angiogenesis and collateral growth in the rabbit hindlimb. J Clin Invest 1998;101:40-50.
- Leibovich SJ, Polverini PJ, et al: Macrophage-induced angiogenesis is mediated by tumour necrosis factor-alpha. Nature 1987;329: 630-2.
- Berse B, Brown LF, et al.: Vascular permeability factor (vascular endothelial growth factor) gene is expressed differentially in normal tissues, macrophages, and tumors. Mol Biol Cell 1992;3: 211-0.
- Rehman J, Li J, et al.: Peripheral blood “endothelial progenitor cells” are derived from monocyte/macrophages and secrete angiogenic growth factors. Circulation 2003;107:1164-9.
- Shireman PK : The chemokine system in arteriogenesis and hind limb ischemia. J Vasc Surg 2007;45(Suppl A):A48e56.
- Liekens S, De Clercq E, Neyts J.: Angiogenesis: regulators and clinical applications. Biochem Pharmacol 2001;61: 253-70.
- van Royen N, Hoefer I, et al.: Effects of local MCP-1 protein therapy on the development of the collateral circulation and atherosclerosis in Watanabe hyperlipidemic rabbits. Cardiovasc Res 2003; 57:178-85.
- Tateno K, Minamino T, et al.: Critical roles of muscle-secreted angiogenic factors in therapeutic neovascularization. Circ Res 2006;98: 1194-202.
- Inaba S, Egashira K, Komori K.: Peripheral-blood or bone- marrow mononuclear cells for therapeutic angiogenesis? Lancet 2002;360:2083. author reply 4.
- Sugihara S, Yamamoto Y, et al.: Autoperipheral blood mononuclear cell transplantation improved giant ulcers due to chronic arteriosclerosis obliterans. Heart Vessels 2006;21: 258-62.
- Hoshino J, Ubara Y, et al.: Quality of life improvement and long-term effects of peripheral blood mononuclear cell transplantation for severe arteriosclerosis obliterans in diabetic patients on dialysis. Circ J 2007;71:1193-8.
- Nevskaya T, Ananieva L, et al:. Autologous progenitor cell implantation as a novel therapeutic intervention for ischaemic digits in systemic sclerosis. Rheumatology (Oxford) 2009;48:61-4.
- Moriya J, Minamino T, et al.: Long-term outcome of therapeutic neo- vascularization using peripheral blood mononuclear cells for limb ischemia. Circ Cardiovasc Interv 2009;2:245-54.
- Kamata Y, Iwamoto M et al.: Repeated local implantation of autologous peripheral blood mononuclear cells for the treatment of ischaemic digits in patients with connective tissue diseases. Rheumatology (Oxford) 2011;50: 906-10.
- Kawamura A, Horie T, et al.: Prevention of limb amputation in patients with limbs ulcers by autologous peripheral blood mononuclear cell implantation. Ther Apher Dial 2005;9:59e63.
- Minamino T, Toko H, et al.: Peripheral-blood or bone-marrow mononuclear cells for therapeutic angiogenesis? Lancet 2002;360:2083-4. author reply 4.
- Raval Z, Losordo DW : Cell therapy of peripheral arterial disease: from experimental findings to clinical trials. Circ Res 2013;112:1288e302.
- Huang PP, Yang XF et al.: Randomised comparison of G-CSF-mobilized peripheral blood mononuclear cells versus bone marrow-mononuclear cells for the treatment of patients with lower limb arteriosclerosis obliterans. Thromb Haemost 2007;98:1335-42.
- Dubsky M, Jirkovska A, et al.: Both autologous bone marrow mononuclear cell and peripheral blood progenitor cell therapies similarly improve ischaemia in patients with diabetic foot in comparison with control treatment. Diabetes Metab Res Rev 2013; 29:369-76.
- Cencioni C, Melchionna R, et al. Ex vivo acidic pre- conditioning enhances bone marrow ckitþ cell therapeutic potential via increased CXCR4 expression. Eur Heart J 2013;34:2007 e16.
- Sprengers RW, Moll FL, et al. Rationale and design of the JUVENTAS trial for repeated intra-arterial infusion of autologous bone marrow-derived mononuclear cells in patients with critical limb ischemia. J Vasc Surg 2010; 51:1564e8.
- Murphy MP, Lawson JH, et al. Autologous bone marrow mononuclear cell therapy is safe and promotes amputation-free survival in patients with critical limb ischemia. J Vasc Surg 2011;53: 1565e1574.e1.
- Kirana S, Stratmann B, et al.: Autologous stem cell therapy in the treatment of limb ischaemia induced chronic tissue ulcers of diabetic foot patients. Int J Clin Pract 2012; 66:384e93.
- Mutirangura P, Ruangsetakit C, et al. Enhancing limb salvage by non-mobilized peripheral blood angiogenic cell precursors therapy in patients with critical limb ischemia. J Med Assoc Thai 2009;92:320e7.
- Prochazka V, Gumulec J, et al. Cell therapy, a new standard in management of chronic critical limb ischemia and foot ulcer. Cell Transplant 2010;19:1413e24.
- Fadini GP, Agostini C, Avogaro A. Autologous stem cell therapy for peripheral arterial disease meta-analysis and systematic review of the literature. Atherosclerosis 2010;209: 10e7.
- Ozturk A, Kucukardali Y,et al. Therapeutical potential of autologous peripheral blood mononuclear cell transplantation in patients with type 2 diabetic critical limb ischemia. J Diabetes Complications 2012;26:29e33.
- Slaninka I, Fibír A., et al: Use of autologous platelet-rich plasma in healing skin graft donor sites. J. Wound Care 29, 36–41 (2020).
- Kim SA, Ryu HW, et al: Application of platelet-rich plasma accelerates the wound healing process in acute and chronic ulcers through rapid migration and upregulation of cyclin A and CDK4 in HaCaT cells. Mol. Med. Rep. 7, 476–480 (2013).
